La clé USB fournie avec mon premier microscope (dont le contenu est détaillé dans mon article précédent) propose l’installation du logiciel propriétaire Swift Imaging dans sa version 3.0 (en français), ainsi que son manuel d’environ 180 pages (en anglais et en chinois). Mes 35 ans d’expérience en informatique m’ont fait présumer d’un logiciel mal conçu, peu intuitif et déraisonnablement compliqué. Le mode de distribution par clé USB, à l’heure d’Internet, m’évoque un autre temps de l’informatique, révolu.
Mais une fois le logiciel installé sur mon Mac en quelques clics, mes préjugés s’évaporent, après un léger bémol toutefois.
Fenêtre principale
Le bémol en question concerne l’apparence du logiciel : il ne supporte pas le mode sombre. En cause : des icônes monochromes dont la couleur ne s’adapte pas au reste de l’interface. La même remarque est à formuler concernant d’autres éléments de l’interface, notamment certains textes. En tant que développeur, j’ai tendance à dire que ce serait facile à corriger, quoique fastidieux, en utilisant des couleurs abstraites fournies par le système d’exploitation.
L’application n’est pas à l’aise avec le mode sombre du système d’exploitation.
Il suffit de passer sur un thème système clair pour que l’application soit parfaitement utilisable. C’est un peu contraignant mais pas rédhibitoire.
Sélection de la caméra
Le volet de gauche, constitué de plusieurs panneaux, permet la sélection et la configuration de la caméra.
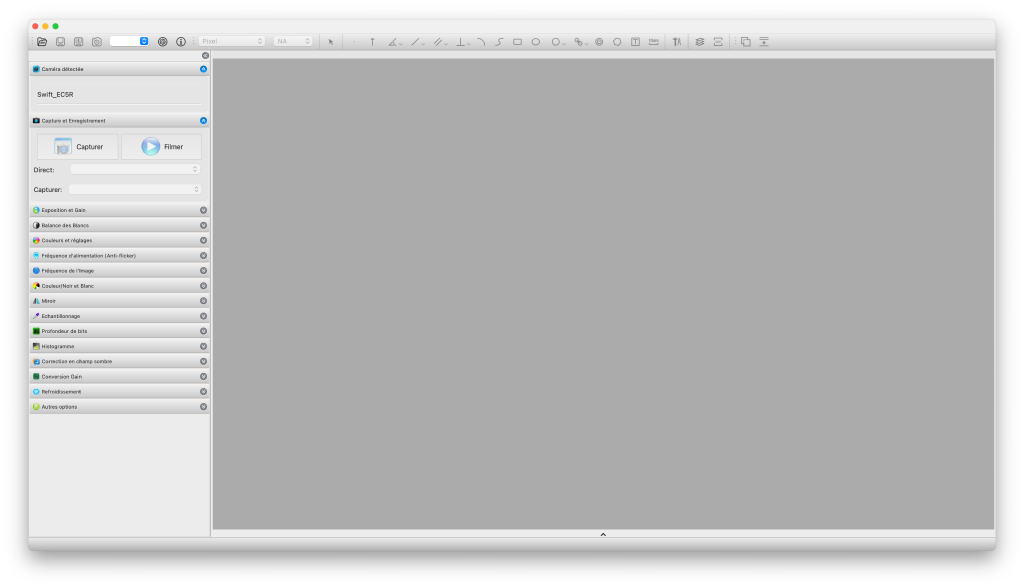
Branchée en USB, la caméra devrait être immédiatement reconnue et listée dans le panneau de gauche. Après l’avoir sélectionnée, les contrôles de paramétrage de la caméra (dans les panneaux inférieurs, toujours à gauche) s’adaptent en fonction des possibilités de la caméra sélectionnée. Mon modèle étant assez basique (comparativement aux autres modèles vendus par Swift), un certain nombre de contrôles disparaissent, épurant ainsi l’interface, ne laissant que le nécessaire.
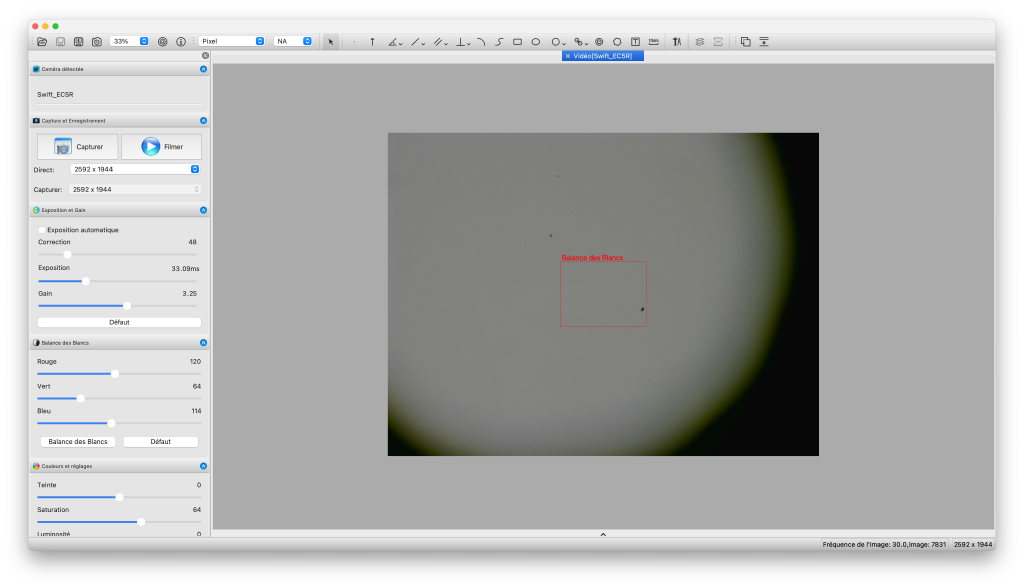
Évidemment, le flux de la caméra apparait alors dans le panneau principal.
Une fois la caméra sélectionnée, son flux s’affiche dans le volet principal. Notez les trois grains visibles, probablement des poussières que je vais avoir du mal à nettoyer compte tenu de leur localisation. Notez aussi que le diaphragme est désaxé. Cela peut être du à un mauvais alignement du tube de la caméra, ou à une mauvaise conception, je l’ignore encore.
Premiers essais
Là encore, comme indiqué dans un article précédent, Swift fourni une boîte de dix lames dont cinq préparées. Je mentionnais que c’était peu, tout en rappelant qu’un microscope à près de 450 euros n’est plus vraiment dédié à la découverte mais à un usage un peu plus avancé. Quoi qu’il en soit, ces lames ont le mérite d’exister : autant les inspecter sans plus tarder !
Les grossissements indiqués ci-après sont ceux des objectifs employés. On ne tient pas compte des grossissement des oculaires qui n’interviennent pas dans l’utilisation de la caméra.
Comme je l’ai indiqué en ouverture de ce site, je ne sais rien d’autre en matière de microbiologie que ce que j’ai appris à l’école il y a plus de vingt ans. En conséquence, j’ai demandé de l’aide à ChatGPT 4 pour nommer ce que j’ai observé, puis j’ai essayé de confirmer grâce, notamment, à la Wikipédia.
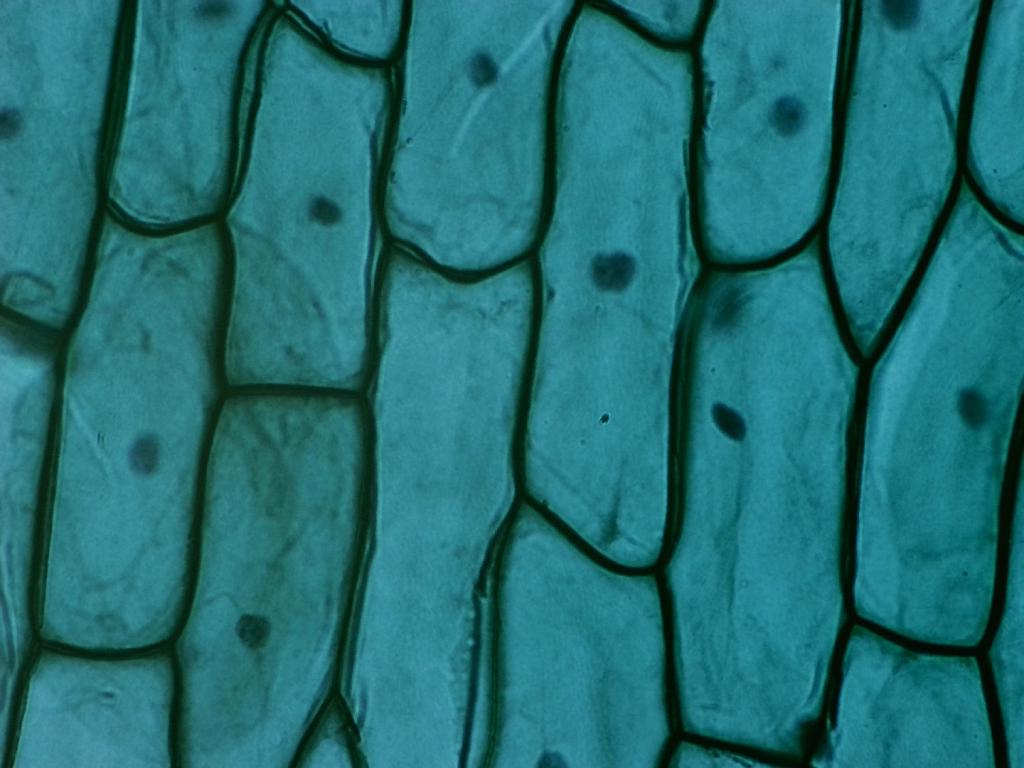
Épithelium d’oignon
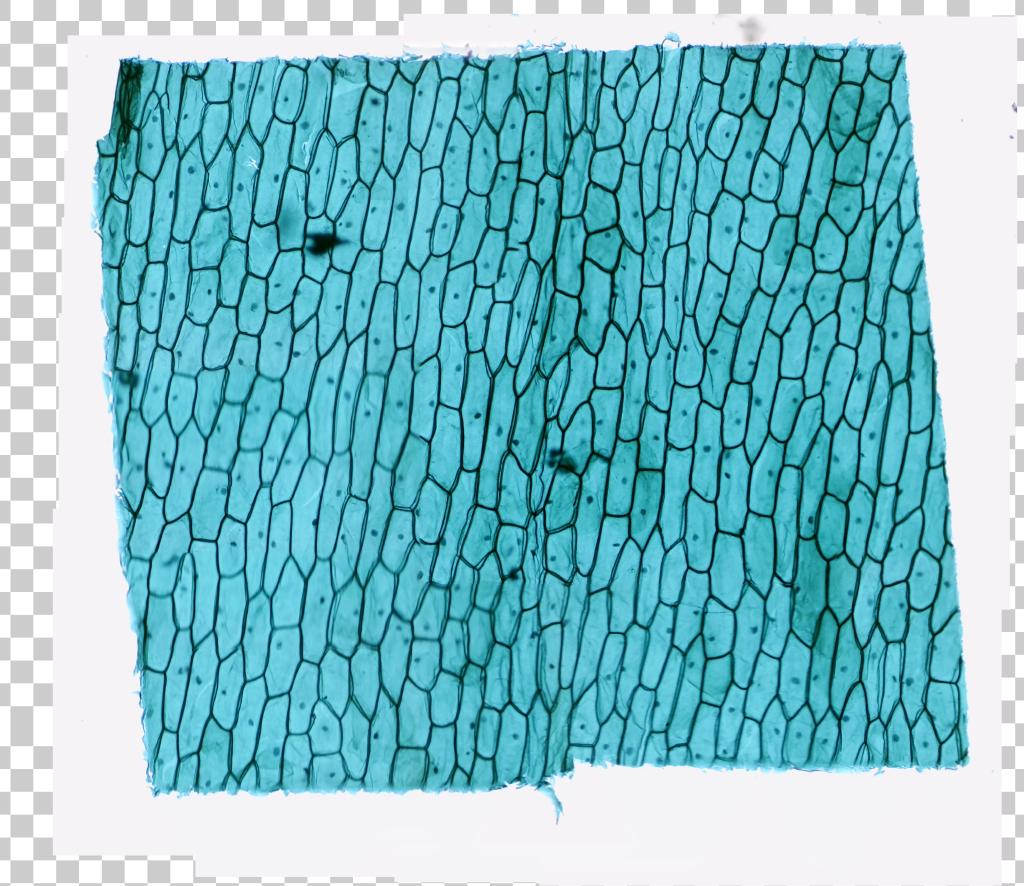
Attribution : Richard Dern
Swift Imaging offre une fonctionnalité intéressante appelée stitching, ou mosaïque, permettant de produire une image unique composée de toute la surface de l’échantillon.
L’une des fonctionnalités les plus intéressantes de l’application est la possibilité de produire des mosaïques avec la technique du stitching (couture) : cela permet de cartographier la surface de l’échantillon en déplaçant le plateau sur l’axe X/Y. Étant donné que sans plateau motorisé, la procédure est un peu fastidieuse, je me suis contenté de le faire à l’objectif 4x.
Le bouton pour démarrer le mode mosaïque se trouve tout à droite de la barre d’outils.

Attribution : Richard Dern
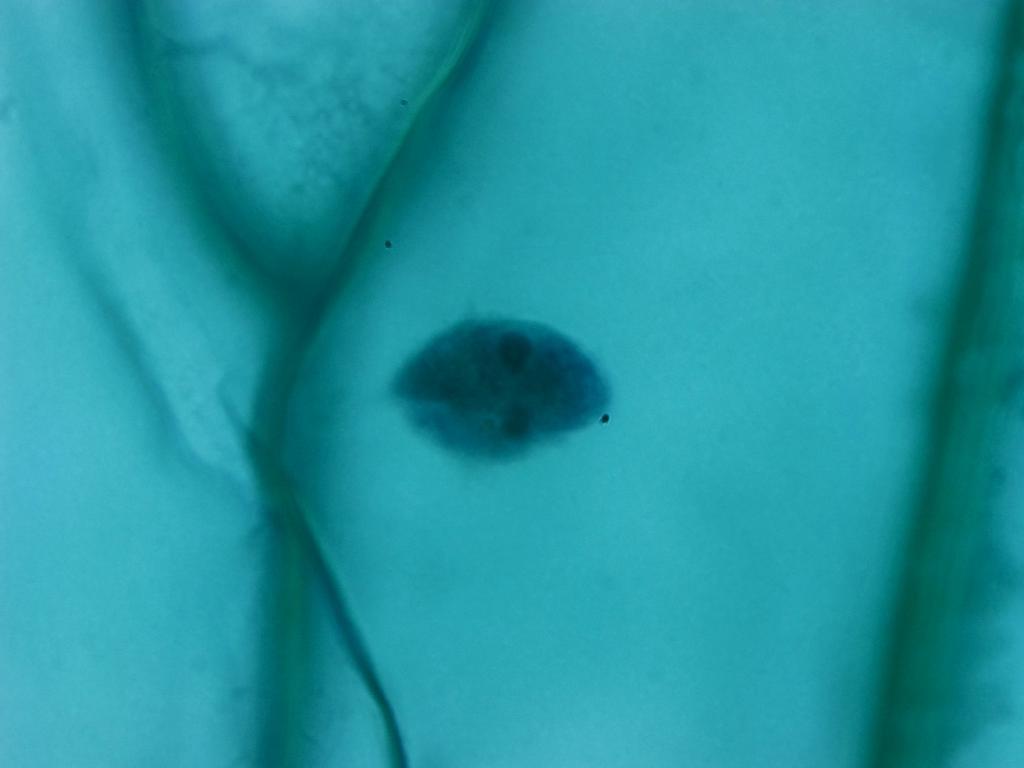
La même lame, observée à l’objectif 10x
On commence à voir que la maîtrise de la lumière est essentielle. Plus on observe le sujet de près, plus il faut l’éclairer. Ici, bien que l’on puisse assez bien observer les membranes et les noyaux des cellules, j’aurais pu augmenter un peu l’apport de lumière. J’aurais pu aussi corriger l’exposition en post-production avec un logiciel de retouche, voire directement dans Swift Imaging.
Attribution : Richard Dern
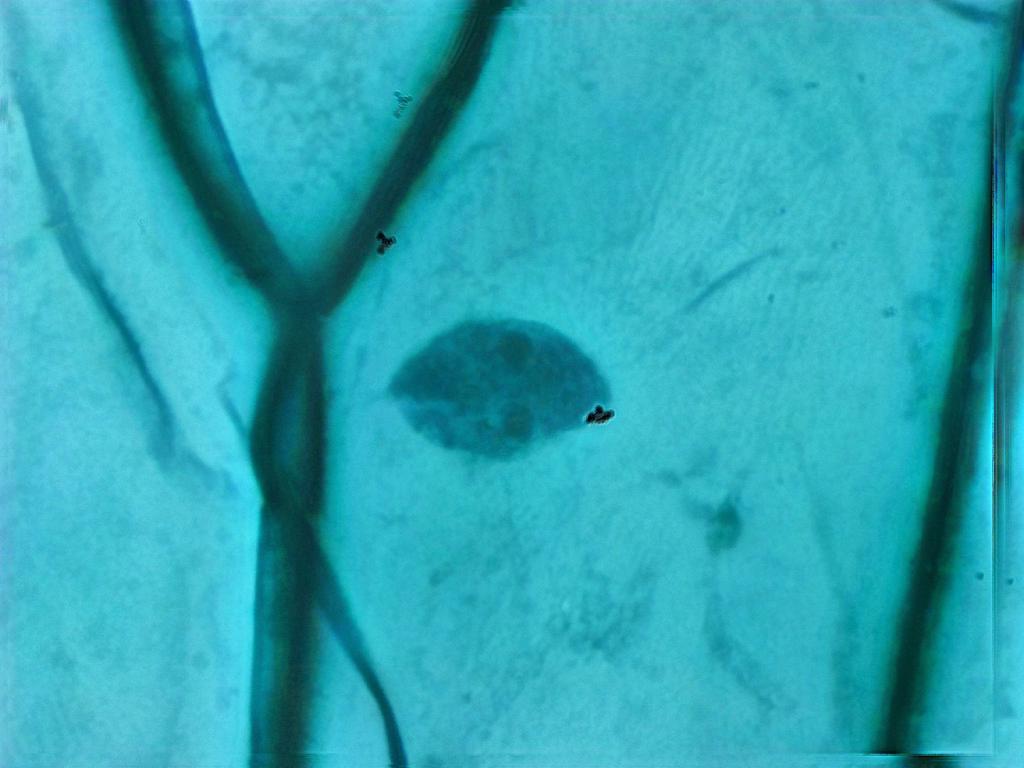
La même lame, observée à l’objectif 40x
Quand on commence à explorer les grossissements supérieurs au 10x, il devient intéressant de jouer avec le condenseur et son diaphragme : cela permet notamment d’intervenir sur le contraste de l’image. Ici, cela m’a permis de mettre en évidence ce qui semble être le nucléole de la cellule.
Swift Imaging offre une autre fonctionnalité intéressante : Enhanced Depth of Field (EDF). Dans ce mode d’observation, on peut améliorer les niveaux de détails d’une image à partir de plusieurs autres images prises à des niveaux différents. Lors de l’usage de ce mode, la précision de l’image est améliorée en jouant sur la molette de réglage fin du microscope. Bien que, comme pour la mosaïque, un peu de pratique sera nécessaire pour en tirer pleinement profit, le logiciel nous simplifie considérablement la tâche.
Le bouton pour démarrer le mode Enhanced Depth of Field (EDF) se trouve à l’extrémité droite de la barre d’outils.

En outre, à partir d’un objectif de 40x, on se rend compte que les mouvements opérés sur et autour du microscope font bouger l’échantillon : il faut apprendre à être délicat ! On peut voir sur la photo suivante que ces mouvements ont provoqué un déclage visible à droite et en bas, et il en résulte une image moins précise que ce que j’aurais pu obtenir.
Attribution : Richard Dern
La même lame, observée à l’objectif 40x avec Enhanced Depth of Field (EDF)
Malgré ces imperfections, la technique de l’EDF met en évidence ici un cytoplasme moins uniforme qu’il ne paraissait auparavant. En vérité, l’EDF sera intéressant dès lors que l’échantillon aura une certaine épaisseur, et à tous les grossissements.
Graine de tournesol
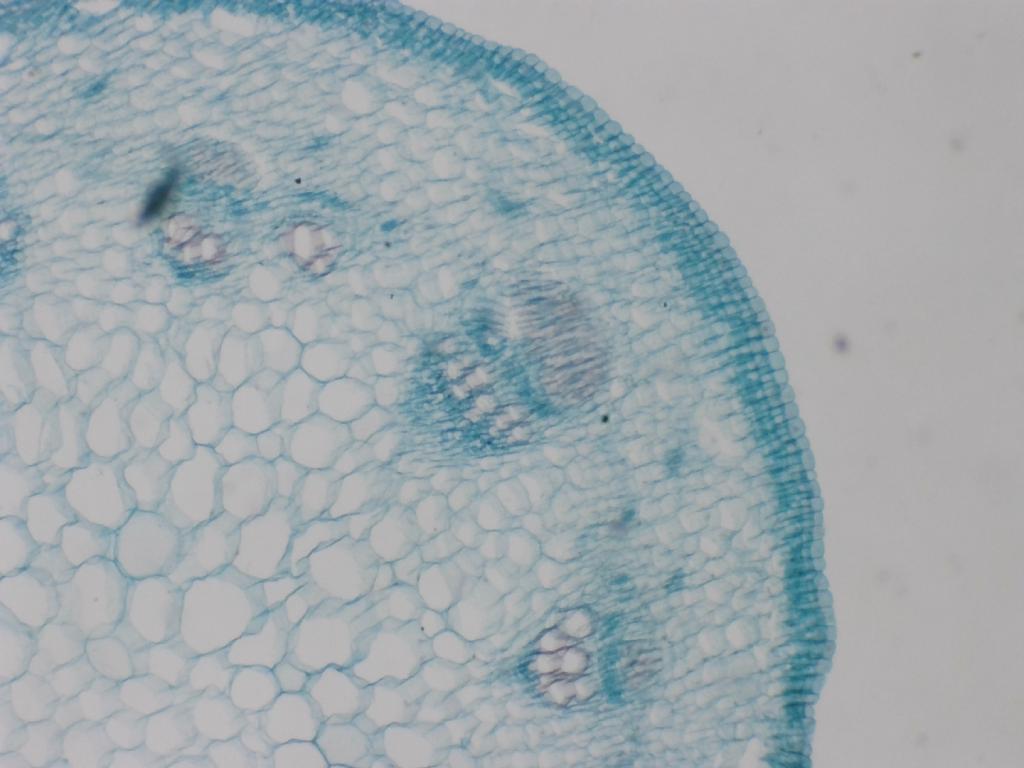
Attribution : Richard Dern
L’observation de la graine de tournesol s’avère assez frustrante : peu importe le grossissement employé et les réglages fins utilisés, l’image semble floue. En réalité, on peut voir que les cellules du bord de la graine sont nettes, mais l’épaisseur de l’échantillon et les caractéristiques des éléments constituant la graine font que leurs parois apparaissent floues.
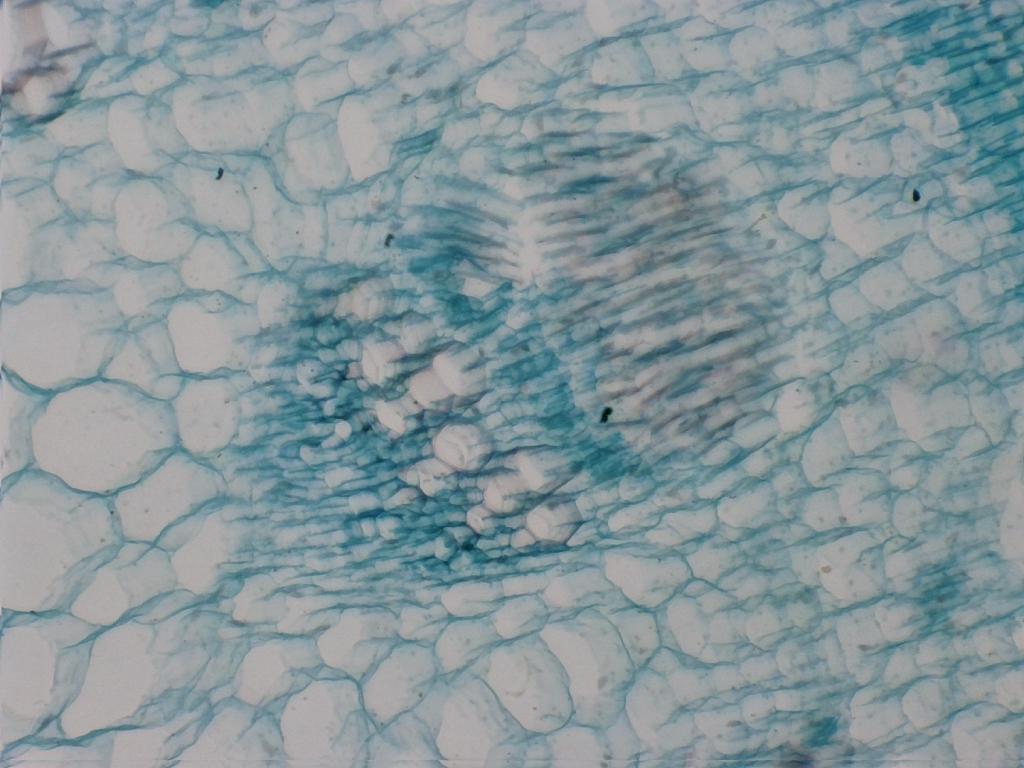
Attribution : Richard Dern
La même lame à l’objectif 10x avec EDF
Comme dit précédemment, l’EDF améliore quelque peu la netteté, tout en montrant des détails intéressants. Ici, on peut observer les tissus vasculaires formant des faisceaux (à droite) orientés vers les cellules du parenchyme.
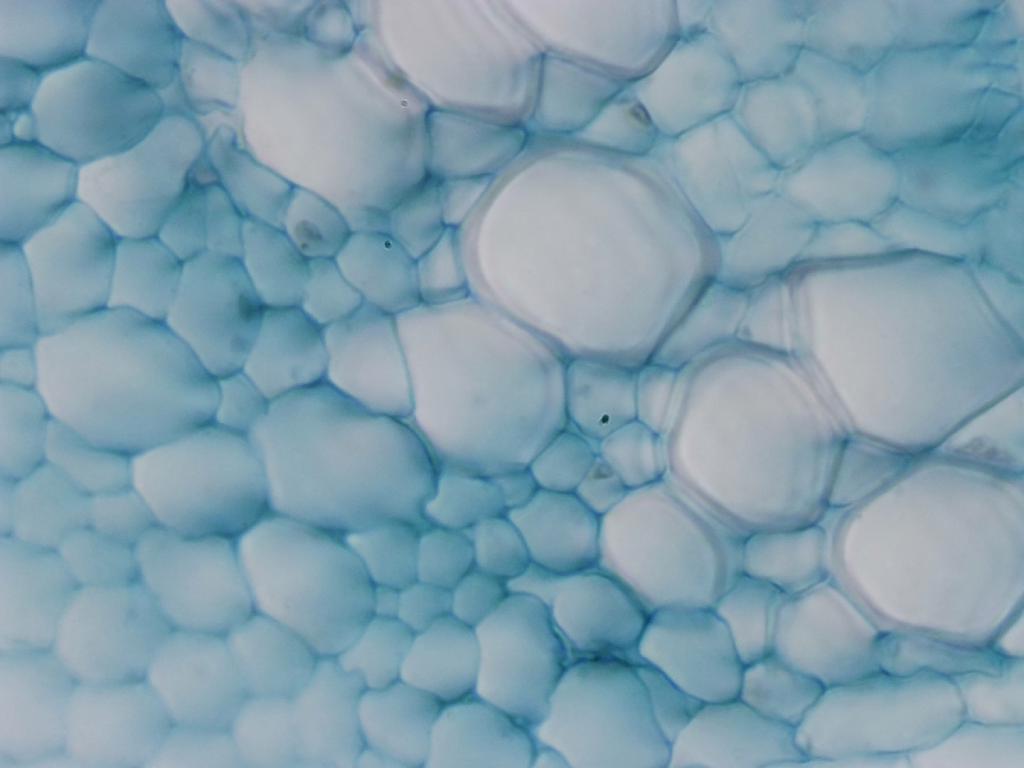
Attribution : Richard Dern
La même lame à l’objectif 40x
En 40x, on peut clairement voir l’aspect “moelleux” des cellules du parenchyme, même sans faire appel à EDF.
Patte d’abeille ouvrière

Attribution : Richard Dern
La lame contenant la patte d’une abeille ouvrière offre un challenge et un résultat intéressant, tous deux dus à l’épaisseur de l’échantillon. Ici, il n’est pas question d’une coupe micrométrique : c’est l’ensemble de la patte qui est proposé.

Attribution : Richard Dern
Pour cette prise de vue, je me suis intéressé au tarse et sa partie intermédiaire, la brosse à pollen. Avec l’EDF, on voit très clairement l’implantation des poils utilisés par l’abeille pour se nettoyer ou collecter le pollen. Les taches noires sur le fond blanc extérieur sont des imperfections du verre de la lame.
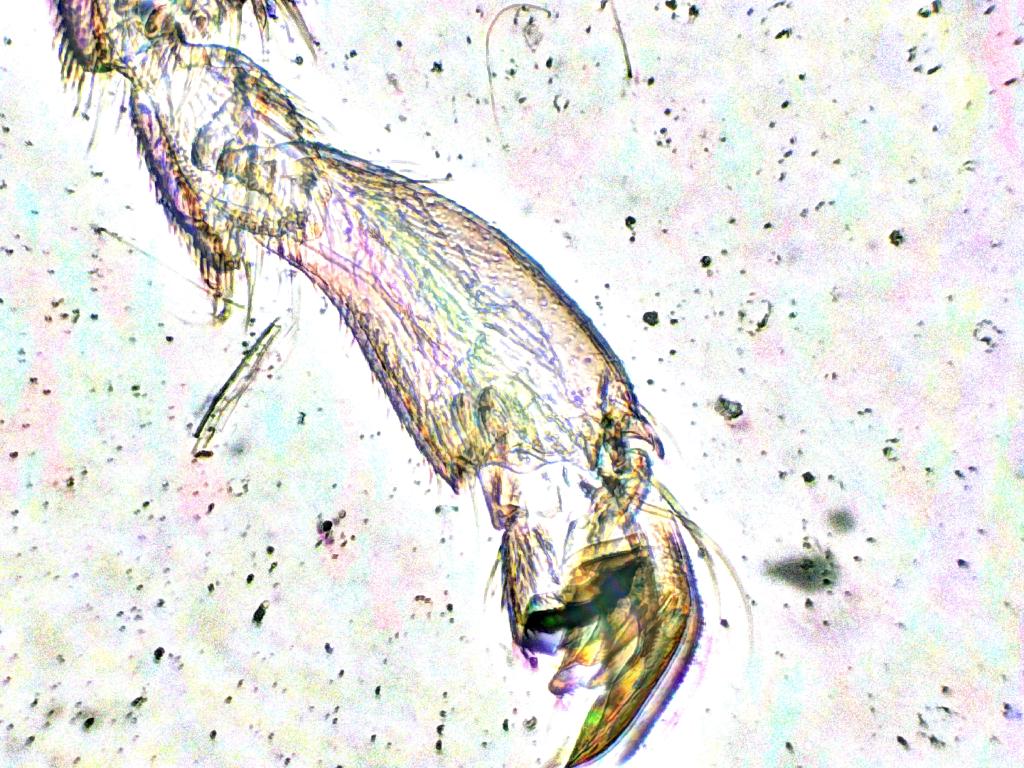
Attribution : Richard Dern
Psychédélique !
L’EDF et le condenseur permettent toutes sortes d’excentricités optiques : fermer (ou ouvrir, comme ici) excessivement le diaphragme peut provoquer des aberrations chromatiques (volontaires ou non) qui, combinées à la composition d’images via l’EDF, peut offrir des effets pour le moins… intéressants !

Attribution : Richard Dern
En 10x, on peut voir des détails de l’articulation des griffes…

Attribution : Richard Dern
…encore plus évidents en 40x avec EDF. Cela reste un peu flou à cause de mon manque de maîtrise.
Il faut vraiment que j’arrive à nettoyer ces poussières… (les trois taches noires au centre et à gauche).
Muscle squelettique de chien
La préparation offerte par Swift manque un peu de colorant : l’échantillon est très pâle et cela se ressent sur les prises de vue, en particulier aux faibles grossissements Peut-être que j’aurais pu, au moins partiellement, corriger cela en post-traitement.
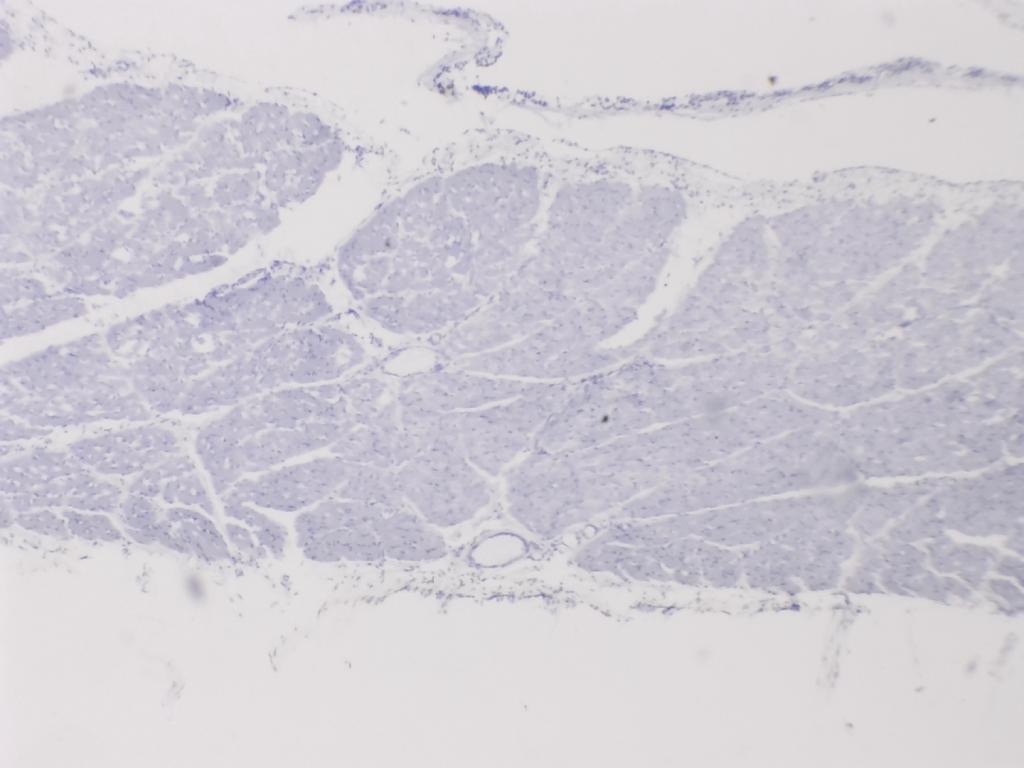
Attribution : Richard Dern
La morphologie classique des tissus musculaires se retrouve sans le moindre doute, y compris au plus faible grossissement.
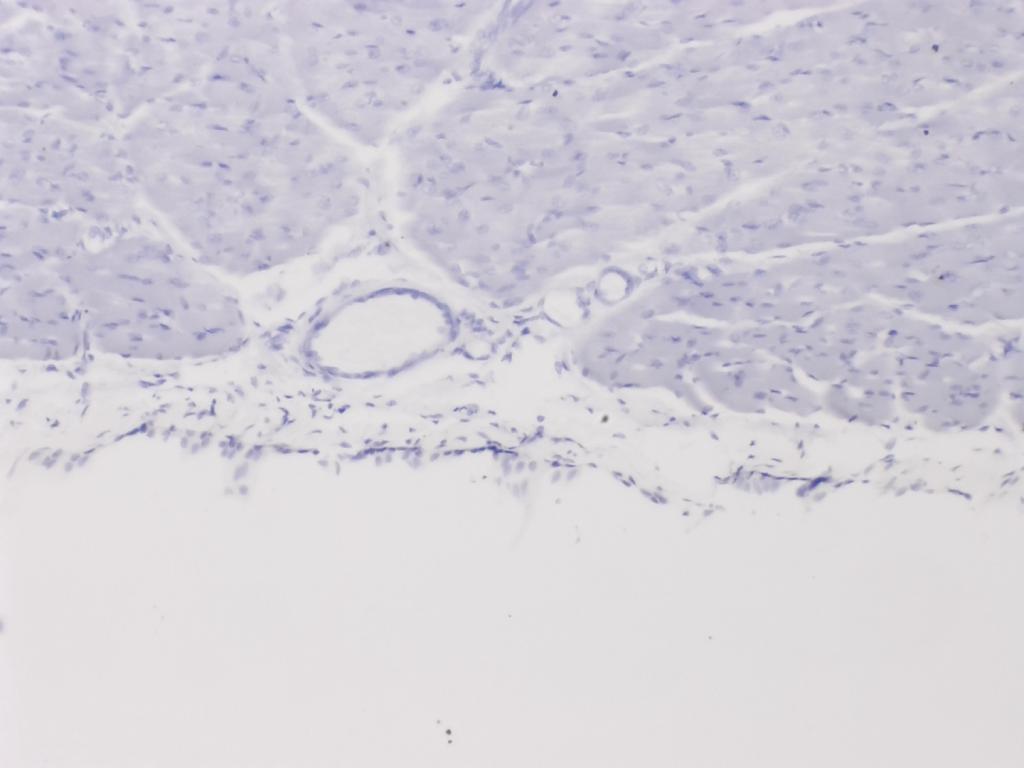
Attribution : Richard Dern
Je me suis focalisé sur cette structure particulière (ici observée au 10x), qui se révèle être une petite veine ou une artère.
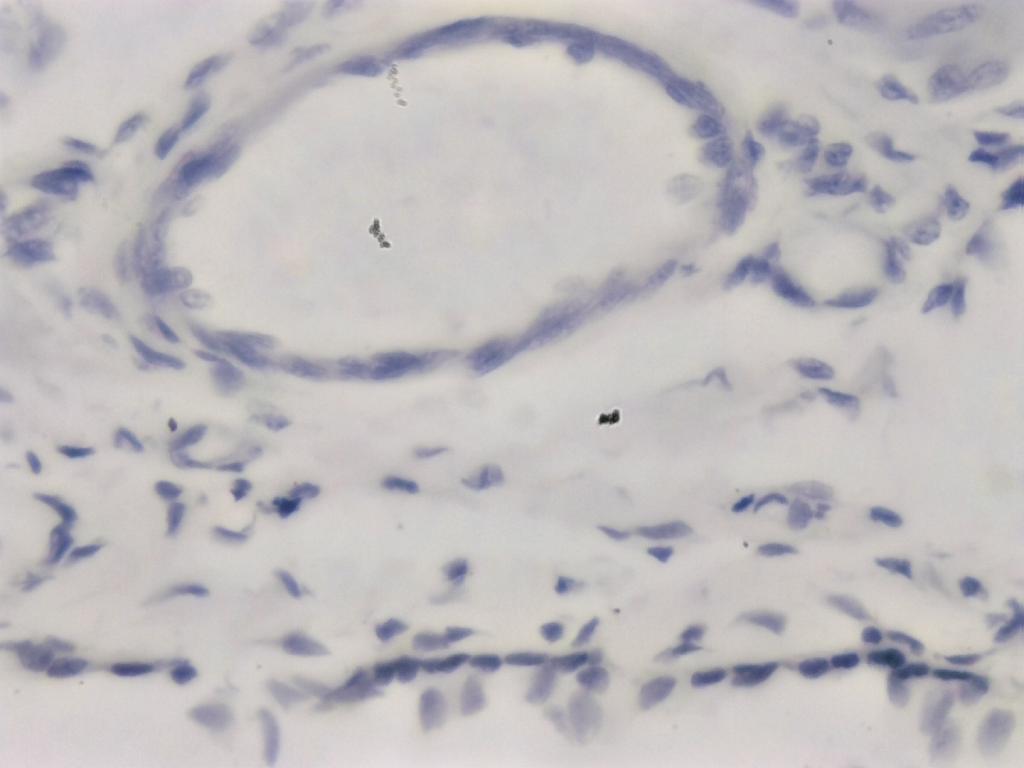
Attribution : Richard Dern
Sur cette photo, bien qu’encore floue malgré l’usage de l’EDF, on peut voir les cellules qui constituent la paroi du vaisseau sanguin.
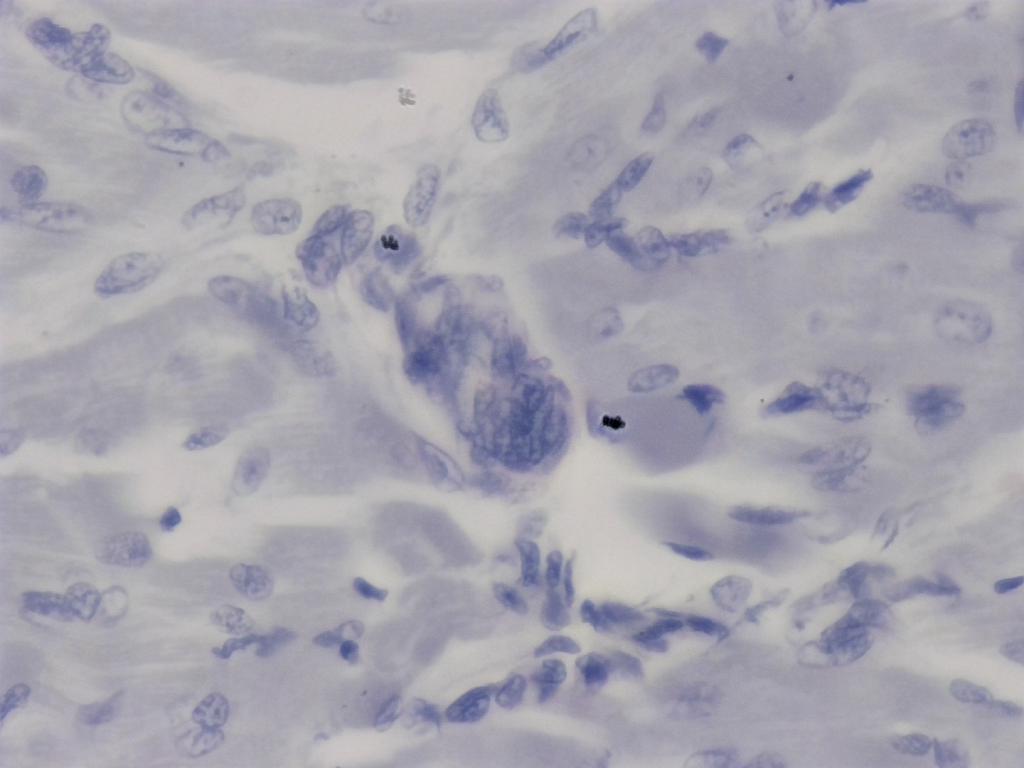
Attribution : Richard Dern
En me promenant sur la lame, j’ai pu voir une structure plus sombre que les autres. Au 40x et avec l’EDF, on s’aperçoit qu’il s’agit d’un amas “inattendu” de cellules, probablement du à une petite inflammation ou un léger traumatisme du muscle.
Testicule de lapin
La lame permettant d’observer une coupe de testicule de lapin est bien colorée, ce qui va nous permettre d’observer des détails intéressants grâce au contraste proposé.
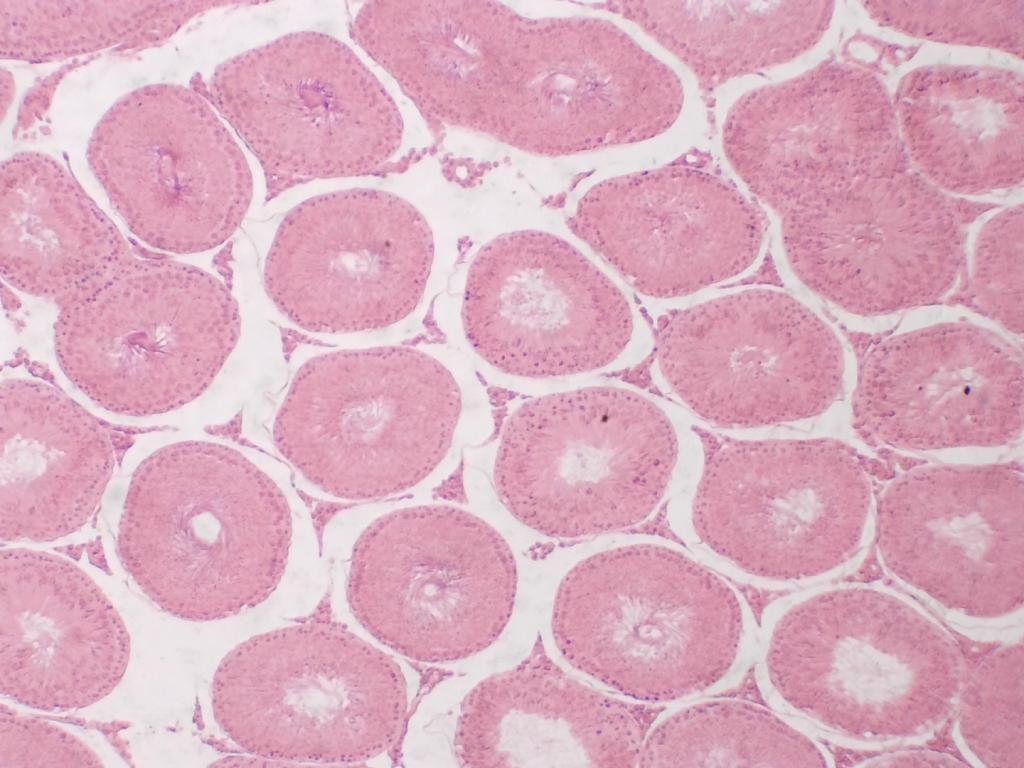
Attribution : Richard Dern
Ainsi, les tubules séminifères sont parfaitement reconnaissables, avec un bon niveau de détail et de contraste dès le plus faible grossissement.
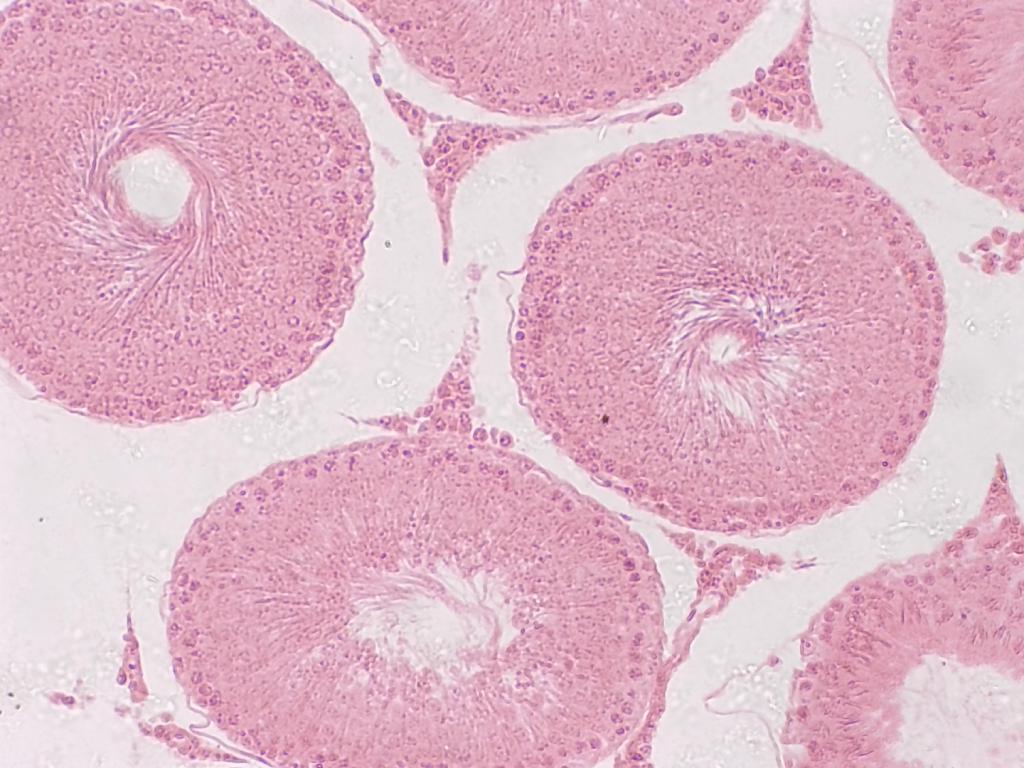
Attribution : Richard Dern
En passant à l’objectif 10x, on commence à voir les cellules de Leydig dans le tissus intersticiel, et la structure en faisceaux spiralés au centre des tubules.
Attribution : Richard Dern
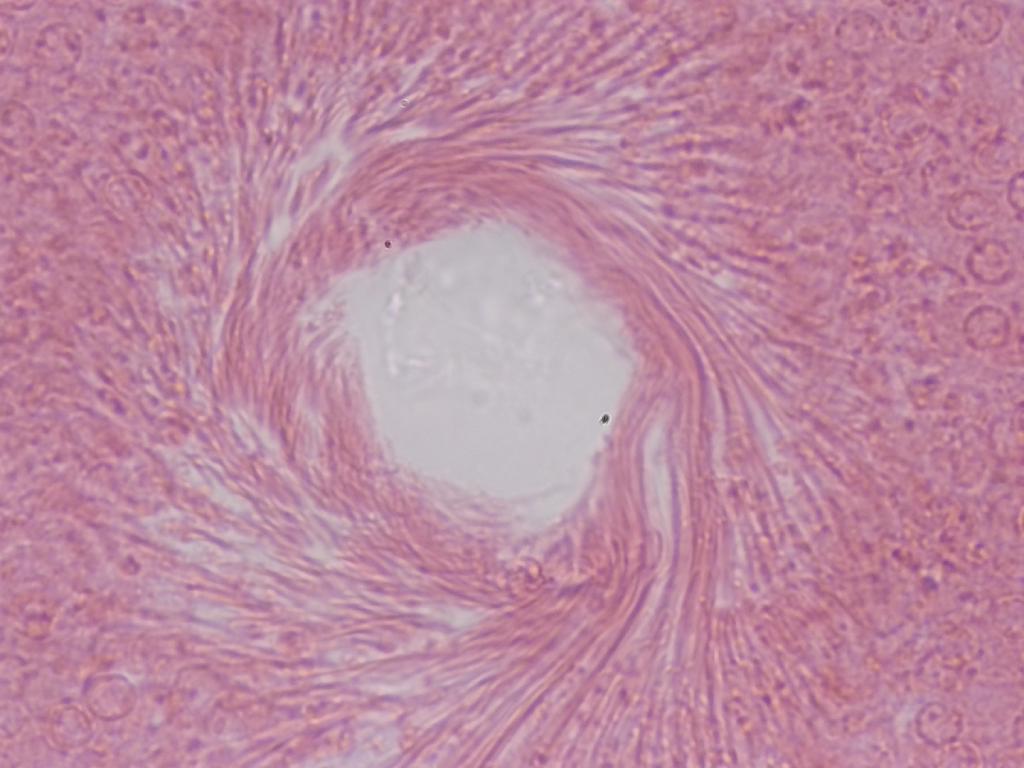
C’est au centre de ce “vortex” (ici vu au 40x) que sont libérés les spermatozoïdes à l’issue de la spermatogenèse.
Attribution : Richard Dern
Pour ma première observation à l’objectif 100x, je ne me suis pas risqué à employer l’huile à immersion. Néanmoins, cela permet d’avoir un aperçu un peu plus précis, quoique flou, des cellules de Leydig.
Conclusion
Swift Imaging v3.0
Le logiciel est une bonne surprise pour moi. La facilité avec laquelle j’ai pu faire une mosaïque et jouer avec la profondeur de champ me laisse penser qu’il ne constituera pas un maillon faible dans mes observations. Je craignais qu’en plus de devoir apprendre à maitriser mon matériel, je doive également subir une courbe d’apprentissage importante de la partie logicielle.
J’apprécie la gratuité de l’application, évidemment, et sa relative ouverture (dans la mesure où un SDK est fourni). Évidemment, il eût été encore plus appréciable, surtout dans une optique de science ouverte et/ou participative, de disposer des sources du logiciel.
Les non-anglophones seront ravis de voir que l’interface est entièrement traduite, au contraire du manuel. En ce qui me concerne, du moment que l’anglais est proposé, cela me convient.
Premières observations
J’ai eu une brève période pendant laquelle je me suis pris d’intérêt pour la photographie “classique”, et je réalise que la même règle d’or s’applique pour la photomicrographie. Elle est même encore plus importante, parce que nous flirtons avec les limites physiques. Il est capital de maîtriser la lumière.
Et force est de constater qu’au cours de mes premières observations, je ne la maîtrise pas ! Pourtant, curieusement, cela m’intimide moins que lors de sessions de photographie “traditionnelle”. Bien au contraire !
Il me reste alors une barrière psychologique à surmonter : l’huile à immersion. Je suis terrifié à l’idée de l’utiliser : j’ai peur d’oublier d’en avoir utilisé et donc d’oublier de nettoyer l’objectif après usage. Mais sans cela, je ne pourrais pas profiter pleinement de l’objectif 100x…

